KLASIFIKASI SENYAWA ORGANIK
OLEH AGUSTININGSIH AMIR
1. Senyawa Rantai Terbuka
(Senyawa Alifatik)
Dalam senyawa rantai terbuka, gugus-gugus yang terikat
pada ikatan sigma dapat berotasi mengitari ikatan tersebut. Oleh karena itu
atom-atom tersebut pada molekul rantai terbuka dapat mengasumsikan berbagai
macam posisi secara relatip gugus yang satu terhadap yang lain. Misalnya
senyawa sederhana etana, dapat memiliki banyak isomer konformasi.
Isomer konformasi adalah senyawa-senyawa yang memiliki rumus molekul,
rumus bangun, sifat kimia, dan sifat fisika yang sama tetapi berbeda posisi
gugusnya secara ruang akibat rotasi bebas melalui ikatan tunggal. Untuk
menggambarkan konformasi dapat digunakab dua tipe formula yaitu tipe flying
wedge drawing dan proyeksi Newman.
Sebelumnya digambar secara proyeksi Fischer lebih
dahulu. Gambar Metana dan Etana secara proyeksi Fischer.
Rumus molekul CH4 dan C2H6
Garis mendatar berarti ikatan keluar bidang menuju
si peninjau. Sedangkan garis ke atas berarti ikatan keluar bidang menuju miring ke atas menjauhi si
peninjau dan garis ke bawah berarti keluar bidang miring ke bawah menjauhi si peninjau.
Senyawa rantai terbuka disebut juga sebagai senyawa
alifatik. Alifatik berasal dari bahasa Yunani aleiphar yang berarti lemak,
sebagaimana senyawa ini sebelumnya diperoleh dari lemak hewani atau nabati,
atau memiliki sifat seperti lemak.
Senyawa
alifatik dibagi menjadi dua:
a. Senyawa alifatik rantai lurus
(tidak siklik)
Misal: Metana, Etana,
Propana, Butana
Susunan atom-atom yang berbeda dalam
suatu ruang yang diakibatkan rotasi bebas melalui ikatan tunggal dinamai Konformasi.
Adanya rotasi bebas melalui ikatan tunggal
C-C peroleh konformasi Etana dengan
rumus bangun yang berbeda sebagai berikut:
Gambaran rumus bangun etana diubah
kedalam proyeksi Newman menjadi sebagai berikut. Atom karbon yang
mengikat atom hidrogen berwarna berada dekat dengan si peninjau.
Gambaran proyeksi Newman Etana,
dengan memutar kekiri 1200 atom hidrogen yang berwarna hijau kearah
merah, merah ke biru , dan biru ke hijau, akan memeperoleh dua molekul
konformer dimana kedua molekul tersebut sama persis atau sama lain hanya
berbeda akibat rotasi bebas melalui ikatan tunggal C-C. Kedua molekul tersebut
dikenal sebagai sepasang isomer konformasi. Konformasi tersebut juga disebut
konformasi staggered.
Konformasi staggered lebih stabil dibanding eclipsed, karena interaksi
hidrogen-hidrogennya lebih kecil.
b. Senyawa alifatik siklik (alisiklik/sikloalkana)
Sikloalkan terdiri atas cincin dengan
unit CH2 mempunyai rumus umum (CH2) atau CnH2n.
Berturut dari lingkar tiga ke lingkar
lima senyawa semakin stabil, karena
tegangan sudut makin mengecil. Pada lingkar 6 terdapat dua bentuk konformasi,
yaitu bentuk kursi yang stabil (konformasi staggered) dan bentuk kapal
(konformasi Eclips) yang tidak stabil.
Senyawa
alisiklik dengan berbagai macam ukuran lingkar ada di dalam alam. Contoh asam
krisantemat, mengandung lingkar tiga siklopropan. Asam ini bersifat pembunuh
insektisida, terdapat dalam bunga krisantemum.
Prostaglandin, misal PGE, mengandung cincin
lingkar lima siklopentana. Prostaglandin merupakan hormonepoten yang mengontrol
fungsi fisiologis dilatasi bronki, dan penghambatan sekresi asam lambung
manusia, terdapat dalam platelet agregat.
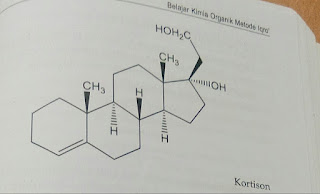
Kortison, mengandung 4 cincin yang
bergabung bersama-sama, tiga darinya merupakan lingkar 6 (sikloheksana) dan sat
lingkar lima (siklopentan).
2. Senyawa Rantai Tertutup
(Senyawa Aromatik)
Gugus-gugus fungsi dalam tabel 6 bila disubstitusikan pada
senyawa aromatik akan memberikan sifat-sifat yang berbeda (misal benzena,
benzaldehida, toluena) dll.
Senyawa hasil isolasi dari sumber alam di antaranya hormon
estron, morfin mempunyai cincin aromatik. Contoh senyawa sintetik yang juga
merupakan bagian dari aromatik adalah diazepam (valium) suatu obat penenang.
Syarat senyawa disebut aromatik :
·
Berbentuk plannar
·
Memiliki sistem ikatan rangkap terkonjugasi
·
Jumlah elektron pi sama dengan Hukum Huckel = 4n + 2
n adalah bilangan bulat yaitu dari nol,1,2,3
dst.
Dengan kata lain hanya molekul dengan elektron pi = 2,6,10,14,18......... dapat disebut
sebagai aromatik. Molekul dengan jumlah elektron pi = 4n (4,8,12,16.....)
tidak
dapat disebut aromatik, walaupun mereka lingkar dan terkonjugasi.
Senyawa planar, yang terkonjugasi dengan 4 n elektron pi
nya mengantarkan ke bentuk molekul yang tidak stabil.
Contoh : penerapan
Hukum Huckel 4n + 2
i.
Siklobutadiena mempunyai 4 elektron pi dan sebagai
antiaromatik. Elektron pi tersebut lebih terlokalisir dalam ikatan rangkap dua
daripada terdelokalisir sekeliling cincin, (terindikasi oleh peta potensial
elektrostatik)
Siklobutadiena,
sangat reaktif dan tidak menunjukkan sifat kearomatikan sama sekali.
Siklobutadiena dibuat oleh Rowland Pettit dari Universitas Texas, tahun1965, pada
temperatur rendah. Bahkan, pada suhu -780C dapat berdimerisasi sendiri sesama siklobutadiena
secara reaksi Diels-Alder. Satu senyawa berperan sebagai dien dan satunya
sebagai dienofil:
Benzena mempunyai
6 elektron pi (4n+2 =6, n=1), merupakan aromatik
ii.
Siklooktatetraena, mempunyai 8 elektron pi dan bukan
aromatik. Elektron pi nya lebih terlokalisir dalam 4 ikatan rangkap dua
daripada terdelokalisir mengitari cincin, dan molekul tersebut lebih cenderung
ke bentuk-Tub daripada planar.
Para ahli kimia pada awal tahun 1900 mempercayai bahwa
persyaratan aromatisitas adalah hanyalah adanya sistem terkonjugasi siklik.
Sehingga diharapkan bahwa siklooktatetraena sebagai analog akhir dari benzena
dan tidak stabil. Akan tetapi faktanya terbukti lan.
Ketika siklooktatetraena pertama kali dinbuat tahun
1911 oleh Richard Willstatter, ahli kimia Jerman, ditemukan bahwa dia tidak
berada pada kestabilan yang khas tetapi reaktivitasnya mirip dengan polien
rantai terbuka.
Siklooktatetraena bereaksi dengan mudah dengan Br2,
KMnO4, dan HCL seperti senyawa alkena lain.
3. Senyawa Heterosiklik
Ketika lebih dari satu jenis atom berada dalam satu senyawa cincin,
mereka dikenal sebagai senyawa heterosiklik. Dalam senyawa ini umumnya satu atau
lebih atom unsur seperti nitrogen 'N', oksigen 'O', atau sulfur 'S' ada di
dalam cincin. Atom selain karbon yaitu N, O atau S yang ada dalam cincin
disebut heteroatom. Senyawa heterosiklik dengan lima dan enam atom disebut
sebagai heterosiklik beranggota lima dan enam. Contohnya adalah piridin, furan,
tiofen, pirol.
Senyawa heterosiklik selanjutnya dapat diklasifikasikan sebagai
monosiklik, bisiklik dan trisiklik tergantung pada jumlah atom penyusun cincin
satu, dua atau tiga.
Hidrokarbon dapat lebih diklasifikasikan menjadi empat jenisberdasarkan
struktur, yaitu:
Alkana
Hidrokarbon yang mengandung ikatan C-C tunggal dalam molekul mereka
disebutalkana. Termasuk rantai terbuka serta tertutup (siklik). Sebagai contoh,
etana, propana siklopentana.
Alkena
Alkenaadalah hidrokarbon yang mengandung setidaknya satu karbon-karbon
ikatan rangkap. Misalnya, etena CH2=CH2AlkunaHidrokarbon
golonganalkunamengandung setidaknya satu karbon-karbon ikatan rangkap tiga.
Misalnya etuna CH≡CH
Arena
Arena adalah hidrokarbon yang mengandung setidaknya mempunyai satu cincin
aromatik atau benzena. Misalnya, benzena, toluena, o-xilena. Mereka juga
mengandung lebih dari satu cincin benzena. Misalnya, naftalena (2 cincin) dan
antrasena (3 cincin).
4. Senyawa Homosiklik
Senyawa-senyawa di mana cincin hanya terdiri dari atom karbon disebut
senyawa homosiklik. Senyawa homosiklik atau senyawa karbosiklik dibagi lagi
menjadi senyawa alisiklik dan senyawa aromatik.
Senyawa alisiklik
Sebuah cincin beranggota tiga atau
lebih atom karbon menyerupai senyawa alifatik seperti dalam senyawa homosiklik
disebut senyawa alisiklik. Hidrokarbon alisiklik jenuh memiliki rumus umum Cn
H2n. Contoh senyawa alisiklik adalah siklopropana, siklobutana, sikloheksana.
Senyawa aromatik
Senyawa ini mengandung cincin benzena
yaitu sebuah cincin dari enam atom karbon dengan ikatan ganda dan tunggal yang
berselang-seling. Disebut senyawa aromatik karena banyak dari mereka yang
memiliki bau yang harum.