KIMIA ORGANIK TENTANG ORBITAL DAN
PERANANNYA DALAM IKATAN KOVALEN
OLEH AGUSTININGSIH AMIR
1.
Orbital
hibridadari Nitrogen dan Oksigen
a.
Atom Nitrogen
Ikatan kovalen tidak
hanya terbentuk dalam senyawa karbon, tetapi juga dapat dibentuk oleh atom-atom
lain. Semua ikatan kovalen yang dibentuk oleh unsur-unsur dalam tabel periodik
dapat dijelaskan dengan orbital hibrida. Secara prinsip, pembentukan hibrida
sama dengan pada atom karbon.
Amonia (NH3) salah satu
contoh molekul yang mengandung ikatan kovalen yang melibatkan atom nitrogen.
Atom nitrogen memiliki konfigurasi ground-state: 1s2, 2s2, 2px, 2py,
2pz, dan memungkinkan atom nitrogen berikatan dengan tiga atom hidrogen.
Ketika terdapat tiga elektron tak berpasangan mengisi orbital 2p, ini memungkinkan orbital 1s dari hidrogen untuk overlap dengan orbital 2p tersebut membentuk ikatan sigma. Sudut ikatan yang terbentuk adalah 107.30, mendekati sudut tetrahedral (109.50). Nitrogen memiliki lima elektron pada kulit terluarnya. Pada hibridisasi sp3, satu orbital sp3 diisi oleh dua elektron dan tiga orbital sp3 diisi masing- masing satu elektron.
Ikatan sigma
terbentuk dari overlap orbital hibrida sp3 yang tidak berpasangan tersebut
dengan orbital 1s dari hidrogen menghasilkan molekul ammonia. Dengan demikian,
ammonia memiliki bentuk geometri tetrahedral yang mirip dengan metana. Ikatan N-H memiliki panjang 1.01 A dan
kekuatan ikatan 103 kkal/mol.
Nitrogen memiliki
tiga elektron tak berpasangan pada orbital hibrid sp3, ketika satu elektron
dalam orbital hibrida tersebut tereksitasi ke orbital p maka terbentuk hibrida
baru, yaitu sp2. Elektron pada orbital p digunakan untuk membentuk ikatan pi.
Jadi, atom nitrogen yang terhibridisasi sp2 memiliki satu ikatan pi yang
digunakan untuk membentuk ikatan rangkap dua, mirip dengan molekul etena.
Apabila elektron yang tereksitasi ke orbital p ada dua maka nitrogen memiliki
kemampuan membentuk dua ikatan pi atau satu ikatan rangkap tiga (hibridisasi
sp).
b.
Atom Oksigen
Elektron pada ground-state atom oksigen memiliki
konfigurasi: 1s2 2s2 2px2 2py1 2pz1, dan oksigen merupakan atom divalen.
Dengan melihat
konfigurasi elektronnya, dapat diprediksi bahwa oksigen mampu membentuk dua
ikatan sigma karena pada kulit terluarnya terdapat dua elektron tak berpasangan
(2py dan 2pz)
.
.
Air adalah contoh senyawa yang mengandung oksigen sp3. sudut ikatan yang terbentuk sebesar 104.50. diperkirakan bahwa orbital dengan pasangan elektron bebas menekan sudut ikatan H-O-H, sehingga sudut yang terbentuk lebih kecil dari sudut ideal (109.50), seperti halnya pasangan elektron bebas dalam ammonia menekan sudut ikatan H-N-H.
Oksigen juga dapat
terhibridisasi sp2, yaitu dengan mempromosikan satu elektronnya ke orbital p.
Dalam kondisi ini, oksigen hanya memiliki satu ikatan sigma, tetapi juga memilki satu ikatan pi. Contoh molekul yang memiliki atom oksigen terhibridisasi sp2 adalah pada senyawa-senyawa karbonil.
Satu contoh terakhir
dari hibridisasi orbital yang sering ditemukan adalah boron trifluorida, BF3.
Boron hanya memiliki tiga elektron di kulit terluarnya (1s2 2s2 2px1), hal ini
berarti bahwa boron hanya dapat membentuk paling banyak tiga ikatan. Kita dapat
mempromosikan elektron pada orbital 2s ke orbital 2py, akan tetapi tidak
mungkin melengkapi boron dengan elektron oktet.
Boron tidak memiliki pasangan elektron bebas, sehingga terdapat satu orbital p (2pz) yang kosong. Molekul BF3 yang terbentuk memiliki geometri planar, sehingga dapat dikatakan bahwa boron terhibridisasi sp2.
2.
Ikatan Rangkap Terkonjugasi
Pada molekul organic mengandung lebih dari satu gugus fungsi.Pada polifungsional,
kebanyakan setiap gugus fungsi tidak bergantung pada gugus fungsi lainnya. Namun pada kenyataannya, tidak selalu
begitu.
Ada 2 cara untuk menempatkan ikatan rangkap dalam senyawa organic. Dua
ikatan rangkap yang berasal dari
atom yang berdampingan disebut
ikatan rangkap terkonjugasi.
Ikatan rangkap yang
menghubungkan atom yang tidak berdampingan
disebut ikatan rangkap
terisolasi (terpencil) atau
tidak terkonjugasi.
3.
Benzene
dan Resonansi
a.
Benzene
Benzene (C6H6) adalah senyawa siklik dengan enam atom karbon yang berbentuk seperti cincin. Setiap atom karbon
terhibridisasi sp2
dan cincinnya adalah planar.
Setiap atom karbon mempunyai satu atom hydrogen yang mengikatya, dan setiap atom karbon juga
mempunyai orbital p yang tidak terhibridisasi
tegak lurus terhadap bidang ikatan sigma dari cincin.
Masing-masing dari keenam orbital p ini dapat menyumbangkan satu electron
untuk ikatan pi.
Dengan enam electron p, benzene dapat membentuk tiga ikatan pi. Ketiga ikatan pi dalam cincin dapat digambarkan seperti pada rumus A atau dapat digambarkan seperti pada gambar B.
Diketahui bahwa semua panjang ikatan C-C dalam benzene adalah 1,40 Å. Keenam ikatan lebih panjang dari pada ikatan rangkap C=C, tetapi lebih pendek dari ikatan tunggal C-C. Bila cincin benzene mengandung 3 ikatan rangkap terlokalisasi oleh tiga ikatan tunggal, maka panjang ikatannya akan berbeda.
Para ahli menyimpulkan
bahwa benzene adalah molekul simetrik dan masing-masing dari enam ikatan cincin adalah sama dengan ikatan cincin lainnya.
b.
Resonansi
Metana (CH4) dan etilena
(CH2=CH2) adalah
contoh dari senyawa organic dengan
struktur yang menggunakan garis untuk ikatan pasangan electron). Suatu garis yang menghubungkan dua lambang
atom menyatakan ikatan kovalen antara dua atom.
Benzene adalah contoh
suatu senyawa organic yang tidak dapat
digambarkan secara pasti oleh rumus ikatan valens itunggal.
Kedua rumus ikatan valensi untuk benzene ini
disebut rumusKekule yang
dicetus oleh Friedrich August
kekule pada tahun 1972. Menurut Kekule, kedua
struktur dari benzene bergeser maju
mundur dengan cepat, sehingga
tidak ada yang dapat diisolasi
secara detail satu per satu.
Kedua struktur Kekule dikatakan ada dalam resonansi satu
dengan yang lain, alasan inilah yang
membuat struktur Kekule disebut sebagai lambangresonansi atau strukturresonansi untuk
benzene.
Struktur benzene
merupakan komposit dari dua struktur resonansi. Jadi, dapat disimpulkan
bahwa benzene adalah hibrida resonansi dari dua struktur
resonansi.
Bila berbagai struktur resonansi dapat ditulis untuk suatu senyawa, maka dapat dibandingkan delokasi dari kerapatan electron.
Struktur nyata adalah gabungan dari semua lambang resonansi.
Senyawa aromatik
bukan hanya satu-satunya senyawa yang rumus ikatan valensi tunggalnya kurang
cocok. Gugus Nitro (NO2) adalah gugus atom yang paling baik
untuk diterangkan dengan menggunakan struktur resonansi. Suatu struktur ikatan
valensi tunggal untuk gugus atom nitro menunjukkan dua jenis ikatan N-O. Namun
demikian, telah diketahui bahwa dua ikatan N-O panjangnya sama.
Struktur resonansi
untuk nitro metana (CH3NO2) seperti pada gambar dibawah
ini. Untuk menunjukkan bahwa ikatan dari nitrogen terhadap oksigen dalam gugus
NO2 adalah sama, beberapa ahli kimia meyajikan gugus nitro dengan
garis titik-titik untuk ikatan rangkap parsial.
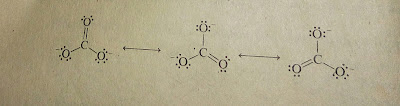
Ion karbonat (CO32-) adalah ion yang tidak dapat dinyatakan oleh struktur ikatan valensi.
Setiap ikatan C-O dalam ion karbonat panjangnya sama. Harus digunakan tiga
struktur resonansi untuk menggambarkan struktur yang nyata.
















menurut saya materi yang anda tampilkan sudah bagus. terimakasih
BalasHapusmateri anda sangat berguna untuk saya terima kasih yaaa :)
BalasHapusmohon anda jelaskan ikatan dari nitrogen terhadap oksigen dalam gugus NO2 adalah sama ?
BalasHapusmenurut saya materi yang disampikan sudah cukup jelas dan lengkap sehingga cukup mudah dimengerti. terimakasih
BalasHapus